A¿QUÉ SON?
Las amidas son derivados funcionales de los ácidos carboxílicos en los que se ha sustituido el grupo -0H por el grupo –NH2, -NHR O –NRR’.También se pueden obtener a partir de las aminas.
CLASIFICACIÓN:
Las amidas se clasifican de acuerdo a:
NOMENCLATURA:
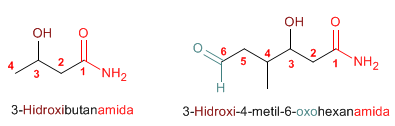
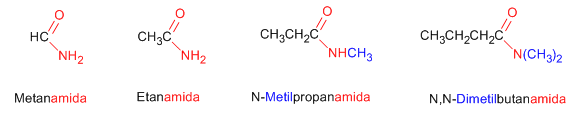
Los nombre comunes de las amidas se forman, mencionando el o los grupos alquilo en orden alfabético a continuación el sufijo –amida.





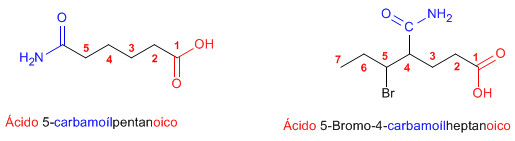
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl....
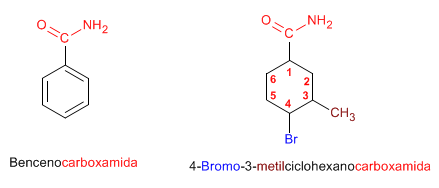
Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
Formamida (metanamida)
FÓRMULA GENERAL:
CLASIFICACIÓN:



La nomenclatura en las aminas aromáticas es similar, como derivados de la anilina si el nitrógeno esta unido al anillo bencénico.

m-metilamina o-bromoanilina
FÓRMULA GENERAL:
CLASIFICACIÓN:
Si tienen un hidrógeno sustituido se conoce como amida sencilla o primaria, las que tienen dos hidrógenos sustituidos se llaman amidas monosustituidas o secundarias y las que tiene tres hidrógenos sustituidos se conocen como amidas disustituidas o terciarias.
DATO: Si todos los sustituyentes son grupos alquilo, las amidas se denominan alifáticas. Si algún sustituyente es un grupo arilo las amidas se llaman aromáticas
NOMENCLATURA:
Los nombre comunes de las amidas se forman, mencionando el o los grupos alquilo en orden alfabético a continuación el sufijo –amida.





En las amidas secundarias y terciarias, si un radical se repite se utilizan los prefijos “di-” o “tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.

Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl....
Formamida (metanamida)
Es un líquido miscible con agua en todas proporciones
Se puede obtener por métodos generales, en particular por deshidratación del formiato de amonio por el calor o con amoníaco y formiato de etilo.
Se prepara industrialmente, sobre todo como materia prima del ácido cianhídrico HCN, con óxido de carbono y amoníaco a presión a 100°C:
Acetamida (etanamida)
Acetamida (etanamida)
Es un sólido cristalizado, perfectamente pura es inodora, pero las impurezas le dan un olor llamado de ratón. Muy soluble en agua, es muy higroscópica.
AMINAS.
¿QUÉ SON?
 |
¿QUÉ SON?
Las aminas son derivados orgánicos del amoniaco, formadas por la sustitución de uno, dos o tres hidrógenos, por grupos alquilo o arilo. El grupo funcional es -NH2.
FÓRMULA GENERAL:
CnH2n+3N
CLASIFICACIÓN:
Las aminas se clasifican de acurdo a que si tiene un hidrogeno sustituido se conoce comoamina primaria, las que tienen dos hidrógenos sustituidos se llaman aminas secundarias y las que tiene tres hidrógenos sustituidos se conocen como aminas terciarias.

DATO: Si todos los sustituyentes son grupos alquilo las aminas se denominan alifáticas. Si algún sustituyente es un grupo arilo las aminas se llaman aromáticas.
NOMENCLATURA:
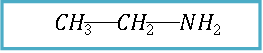
Los nombre comunes de las aminas se forman, mencionando el o los grupos alquilo en orden alfabético y a continuación el sufijo –amina.
Etilamina
Dietilamina
Fenilisobutilmetilamina
Etilamina
Dietilamina
Fenilisobutilmetilamina
Etilmetilpropilamina
En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos “di-” o “tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.
En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos “di-” o “tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.


La nomenclatura en las aminas aromáticas es similar, como derivados de la anilina si el nitrógeno esta unido al anillo bencénico.

m-metilamina o-bromoanilina